医疗器械生物相容性检测评价标准及项目
 347次
347次
 2024.08.16
2024.08.16
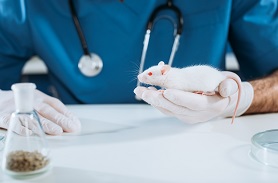
为确保医疗器械的质量以及临床医疗使用的安全、有效,必须对其生产过程中涉及到的非活性材料进行生物相容性评价,以用于生产工艺过程的监控及最终产品的放行。
因此,生物相容性评价是生物材料研究中始终贯穿的主题,也是相关产品生产企业必须关注的问题。中科检测是专业的生物相容性第三方检测机构,开展医疗器械生物相容性检测服务。

医疗器械生物相容性检测标准
消毒技术规范(2002年版)
医疗器械生物学评价第11部分:全身毒性试验GB/T16886.11-2021
医疗器械生物学评价第5部分:体外细胞毒性试验GB/T16886.5-2017
医疗器械生物学评价第10部分:刺激与皮肤致敏试验GB/T16886.10-2017
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T16886.10-2017
《中华人民共和国药典》2020年版四部通则1101
医用输液、输血、注射器具检验方法第2部分:生物试验方法GB/T14233.2-2005
部分生物相容性检测项目依据的标准及方法如上。
医疗器械生物相容性检测项目
常规三项:皮肤刺激试验、致敏试验、体外细胞毒性试验;
遗传毒性试验:鼠伤寒沙门氏菌回复突变试验、基因突变试验、染色体畸变试验、肌肉植入试验、皮下植入实验、骨植入试验、微核试验;
其他项目:热源试验、溶血试验、急性全身毒性试验、亚急性全身毒性试验、亚慢性全身毒性试验、慢性全身毒性试验、血小板粘附试验、血栓形成试验、凝血试捡、补体激活试验、等等;
生物相容性检测的特点及评价原则
1)大部分体内、体外生物学试验检测样品在规定的浸提条件下浸提,进行试验。
2)直接用材料和医疗器械植入体内,与组织、血液或体表组织、血液接触进行试验,大部分的体内试验是通过外科无菌手术操作方式进行的。
3)进行体外细胞培养,观察样品的细胞毒性,测定浸提液或材料对细胞溶解(细胞死亡)、抑制生长的毒性作用。
4)致癌试验是用不同形状、大小、表面状态的材料植入体内某一部位,观察动物整个寿命期材料和医疗器械对体内潜在的致癌作用。
5)血液相容性试验是通过材料和医疗器械直接接触血液,首先观察对血小板激活、血栓形成的凝血作用,其次观察血浆蛋白、血液有形成分和补体系统、细胞因子的作用。
6)植入试验是将生物材料和医疗器械埋入动物体内某些部位,埋入不同时间材料对局部的组织病理学的改变。
7)降解试验是采用各种体内外方法,测定材料和医疗器械的降解程度、力学强度的变化,了解降解产物在体内的吸收、分布、代谢过程,评价材料对机体的有害作用。
生物相容性测试遵循的两大原则有生物安全性原则和生物功能性原则。生物安全性原则的目的在于消除生物材料对人体器官的破坏性,比如细胞毒性和致癌性。
生物材料对于宿主是异物,在体内必定会产生某种应答或出现排异现象,因此要对生物材料进行生物安全性评价,确保材料被宿主接受,不产生有害作用。
生物功能性原则是指在特殊应用中“能够激发宿主恰当地应答”的能力,不仅要对生物材料的毒副作用进行评价,还要进一步评价材料对生物功能的影响。
-
 腻子检测项目有哪些 外墙腻子检测哪些内容腻子检测有哪些项目指标要求?外墙腻子检测包括哪些内容?下面跟着中科检测小编来了解。
腻子检测项目有哪些 外墙腻子检测哪些内容腻子检测有哪些项目指标要求?外墙腻子检测包括哪些内容?下面跟着中科检测小编来了解。 -
 腻子检测项目有哪些 外墙腻子检测哪些内容腻子检测有哪些项目指标要求?外墙腻子检测包括哪些内容?下面跟着中科检测小编来了解。
腻子检测项目有哪些 外墙腻子检测哪些内容腻子检测有哪些项目指标要求?外墙腻子检测包括哪些内容?下面跟着中科检测小编来了解。 -
 医疗器械生物相容性检测评价项目如何选择?有哪些标准?生物相容性是指生命体组织对非活体材料产生反应的一种性能。旨在保证医疗器械、医用材料与人体之间相互作用下对人体无毒性、无致敏性、无刺激性、无遗传毒性、无致癌性,对人体组织、血液、免疫系统无不良反应。
医疗器械生物相容性检测评价项目如何选择?有哪些标准?生物相容性是指生命体组织对非活体材料产生反应的一种性能。旨在保证医疗器械、医用材料与人体之间相互作用下对人体无毒性、无致敏性、无刺激性、无遗传毒性、无致癌性,对人体组织、血液、免疫系统无不良反应。 -
 医疗器械生物相容性检测结果判定要求生物相容性测试涉及对医疗器械与人体相互作用的安全性和适用性进行评估。这包括确保医疗器械对人体的毒性、致敏性、免疫反应等方面的影响在可接受范围内,从而保障使用医疗器械的安全性。
医疗器械生物相容性检测结果判定要求生物相容性测试涉及对医疗器械与人体相互作用的安全性和适用性进行评估。这包括确保医疗器械对人体的毒性、致敏性、免疫反应等方面的影响在可接受范围内,从而保障使用医疗器械的安全性。